根拠に基づく医療(こんきょにもとづくいりょう、Evidence-based medicine: EBM)とは、「個々の患者のケアに関する意思決定において、現在の最良のエビデンスを意識的、明示的かつ思慮深く用いること (conscientious, explicit, and judicious use of current best evidence)」である。 エビデンスに基づく医療とも呼ぶ。EBMの目的は、臨床医の経験、患者の価値観、および入手可能な最良の科学的情報を統合して、臨床管理に関する意思決定を導くことである。この用語はもともと、医学の実践を指導し、個々の患者に関する個々の医師の意思決定を改善するための手段を説明するために使用されていた。
概要
医学および保健医療の分野におけるエビデンスとは、一般的には「科学的根拠」という意味である。そして、ある治療法・検査法が、ある病気・怪我・症状に対して、科学的に効果があることを示す根拠となる検証結果・臨床研究結果を指す。EBMにおいては、メタ分析、システマティック・レビュー、ランダム化比較試験の実施と結果の採用が強く推奨されている。EBMが医療分野に及ぼした影響は大きく、パラダイムシフトと称されている。この用語の使用は急速に広まり、患者に適用される指針を立案するにあたってエビデンスの活用に重点を置いた手法が取り入れられるようになった。健康管理のあらゆる場面や、非医療分野における意思決定への取り組み方について説明する際にもこの用語が広がっていった。
EBM以前は病態生理学的に正しければ、診療結果も正しいだろうと考えられていた。例えば、抗不整脈薬によって不整脈を抑制すれば、死亡率も減るだろうと考えられていた。しかしこれはむしろ死亡率が上昇することが1991年のランダム化比較試験で実証された(CAST研究(Cardiac Arrhythmia Suppression Trial))。現代では、病態生理学的推論よりも臨床研究によって実証されたエビデンスが重視されるようになっている。
EBMピラミッドは、医学におけるエビデンスレベルを視覚化するのに役立つツールである。診療ガイドラインやシステマティック・レビューはピラミッドの上部、すなわち権威があり、信頼がおけるものとされる一方、専門家の意見であってもピラミッドの下部に位置する。動物実験に至ってはピラミッドの最下段にしかランクされない(右図)、または、ピラミッドに採用されていない。
EBMの利点は以下の通りである。
- 根拠に基づく医療は、特に誤った診断、時代遅れの危険な検査や処置、薬の過量投与に関わる有害事象を減らす可能性がある。
- 診療ガイドラインは、臨床医、患者、そして医療関係者以外の医療受益者の間のコミュニケーションを改善するための共通の枠組みを提供する。
- シフトの変更や複数の専門医に関連するエラーは、一貫したケアプランによって減少する。
- 治療やサービスの臨床的有効性に関する情報は、医療の提供者、消費者、購入者が限られた資源をより有効に活用するのに役立つ。
- 医療の進歩に伴い、医師や看護師はガイドラインが改善されるにつれて、新しい検査や治療に対応できるようになる。
EBMの欠点は以下の通りである。
- ガイドラインは一般的なスクリーニングのために作られたものではなく、むしろ個々の医療従事者が特定の患者を評価する際の意思決定ツールとして作られたものであるというエビデンスがあるにもかかわらず、マネージド・ケア側は医療費削減のために"不必要な"サービスを制限しようとするかもしれない。
- 医学文献は進化しており、しばしば論争がある。ガイドラインの作成にはコンセンサスが必要である。
- ガイドラインを導入し、施設内の医療チーム全体を教育するには、時間と資源を必要とする(それは将来の効率化とエラーの減少によって回収できるかもしれない)。
- 医療従事者は、エビデンスに基づく医療を、患者、医師、その他の医療専門家の伝統的な関係を脅かすものとして抵抗するかもしれない。
- ガイドラインに従わない場合、規制当局による法的責任や懲戒処分のリスクが高まる可能性がある。
「根拠に基づく医療」(evidence-based medicine: EBM)という用語は、1990年にマックマスター大学のゴードン・ガイアットによって導入されたものである。
背景、歴史、定義
エビデンスに基づく考え方の萌芽
医学には、ヒトの疾病の予防、診断、治療に関する科学的探求の長い歴史がある。11世紀、ペルシアの医師であり哲学者であったイブン・スィーナーは、現在の考え方や実践とほぼ同様のEBMへのアプローチを開発した。
対照臨床試験の概念は、1662年にヤン・ファン・ヘルモントによって、瀉血の実践に関して初めて記述された。
対照臨床試験の実施と結果を記した最初の報告書は、スコットランドの海軍外科医ジェームズ・リンドによるもので、彼は海峡艦隊のHMSソールズベリーに乗船し、ビスケー湾をパトロールしている間に壊血病の研究を行った。リンドは研究に参加した水兵を6つのグループに分け、さまざまな治療の効果を公平に比較できるようにした。リンドは、レモンやオレンジで治療したグループの中で壊血病の症状や徴候が改善したことを発見した。彼は1753年にこの実験結果を記した論文を発表した。
医学における統計的手法の初期の批評は膀胱結石に関するもので1835年に発表されている。
臨床推論の限界の露呈
1967年にアルヴァン・ファインスタインが"Clinical Judgment"を出版し、臨床推論の役割に注目し、臨床推論に影響を与えうるバイアスを特定した。1972年にアーチー・コクランが"Effectiveness and Efficiency"を出版し、それまで効果的であるとされてきた多くの診療には、それを裏付ける対照試験が無いと述べた。1973年、ジョン・ウェンバーグは、医師がどのように診療を行っているかに大きな違いがあることを記録し始めた。1980年代を通して、デイビッド・エディは、臨床推論の誤りやエビデンスのギャップについて述べた。1980年代半ばには、アルビン・ファインスタイン、デイビッド・サケットらが臨床疫学の教科書を出版し、疫学的手法を医師の意思決定に応用した。1980年代末には、ランド研究所のグループが、医師が行う処置の大部分が、彼ら自身の専門家の基準に照らしても不適切であると考えられることを示した。
"Evidence based"の誕生
デイビッド・エディが「エビデンスに基づく(Evidence based)」という言葉を最初に使い始めたのは1987年で、専門医学会協議会から依頼された、診療ガイドラインを作成するための正式な方法を学ぶためのワークショップとマニュアルにおいてであった。このマニュアルは最終的に米国内科学会(American College of Physicians: ACP)から出版された。エディが「エビデンスに基づく」という言葉を初めて発表したのは1990年3月のことで、JAMA誌に掲載された論文で、エビデンスに基づくガイドラインと集団レベルの方針の原則を示したものであった。そこで、エディは、「政策に関連する利用可能なエビデンスを明確に記述し、標準的なケアの実践や専門家の信念ではなく、エビデンスに政策を結びつける。適切なエビデンスを特定し、説明し、分析しなければならない。政策立案者は、その政策がエビデンスによって正当化されるかどうかを判断しなければならない。根拠を書かなければならない。」と表現した。彼は、1990年春にJAMA誌に発表された他のいくつかの論文の中で、エビデンスに基づく政策について論じている。これらの論文は、1990年から1997年にかけてJAMA誌に発表された、集団レベルのガイドラインや政策を設計するための正式な方法に関する一連の論文28報の一部であった。
EBMの概念の確立
根拠に基づく医療(Evidence Based Medicine: EBM)という言葉は、医学教育の文脈で、少し遅れて導入された。1990年秋、ゴードン・ガイアットが、マックマスター大学での医学部入学予定者や新入生向けのプログラムに関する未発表の記述の中でこの用語を使用した。ガイアットらは、2年後(1992年)に、医学の実践を教えるための新しいアプローチを説明するために、この用語を初めて発表した。
1996年、デイビッド・サケットらは、このEBMの支流を以下のように明確に定義した。「個々の患者のケアに関する意思決定において、現在の最良のエビデンスを良心的、明示的かつ思慮深く用いること…、また。個人の臨床的な専門知識と、体系的な研究から得られる最良の外部からの臨床エビデンスを統合することを意味する」。EBMのこの支流は、研究からのエビデンスをよりよく反映させることで、個人の意思決定をより構造的かつ客観的なものにすることを目的としている。効果的かつ効率的な診断、個々の患者の苦境、権利、嗜好の思慮深く特定し、思いやりをもって反映される臨床的専門知識を医療従事者が持っているという事実を尊重しつつ、集団ベースのデータが個々の患者のケアに適用される。
1993年から2000年にかけて、マックマスター大学のEBMワーキンググループは、JAMA誌に25の「医学文献ユーザーズガイド」を連載し、幅広い医師に向けてその方法を発表した。
1995年、ウイリアム・ローゼンバーグとアンナ・ドナルドは、個人レベルのEBMを「同時期の研究結果を見つけ、評価し、医学的判断の基礎として用いるプロセス」と定義した。2010年、トリシャ・グリーンハルは定量的な方法を強調する定義を使用した。「個々の患者の診断、調査、管理における臨床的意思決定に情報を提供するために、集団サンプルを対象とした質の高い研究から得られた有益性と有害性のリスクの数学的推定値を使用すること」。
前述の2つの定義は、EBMが集団に適用される場合と個人に適用される場合の重要な違いを強調している。個々の医師が修正する機会が比較的稀な状況で、大規模な集団に適用されるガイドラインを設計する場合、エビデンスに基づく政策立案では、検査や治療の有効性を文書化するための優れたエビデンスが無ければならないことが強調される。個人の意思決定の場では、研究結果をどのように解釈し、自分の臨床判断と結びつけるかについて、医療従事者にはより大きな自由度が与えられる。2005年、エディはEBMの2つの分枝に対する包括的な定義を提示した「EBMとは、医療上の意思決定、ガイドライン、その他の種類の政策が、可能な限り、有効性と有益性に関する優れたエビデンスに基づき、それらに合致したものとなるように意図された一連の原則と方法である」。
EBMの普及と発展
エビデンスに基づくガイドラインと政策の分野では、有効性のエビデンスに対しては明示的に徹底する方針が、1980年にアメリカがん協会によって導入された。米国予防医学専門委員会 (USPSTF)は、1984年にエビデンスに基づく原則に基づいた、予防介入のガイドラインの発行を開始した。1985年、ブルークロス・ブルーシールド協会は、新技術をカバーするために、エビデンスに基づく厳格な基準を適用した。1987年以降、アメリカ内科学会などの専門学会や、アメリカ心臓協会などの非営利医療組織が、エビデンスに基づくガイドラインを多数作成した。1991年、米国のマネージドケア組織であるカイザーパーマネンテは、エビデンスに基づくガイドライン・プログラムを開始した。1991年、リチャード・スミスはBritish Medical Journalに論説を執筆し、英国におけるエビデンスに基づく政策の考えを紹介した。1993年、コクラン共同計画は、システマティックレビューとガイドラインを作成するために13カ国のネットワークを作成した。1997年、医療研究品質局(AHRQ、当時は医療政策研究局(AHCPR))は、ガイドラインの開発を支援するためのエビデンスレポートや技術評価を作成するために、「エビデンスに基づく診療センター」(Evidence-based Practice Centers: EPCs)を設立した。同年、AHRQ、アメリカ医師会(AMA)、American Association of Health Plans(現在のAmerica's Health Insurance Plans)によって、エビデンスに基づく政策の原則に従った米国ガイドラインセンター(National Guideline Clearinghouse: NGC)が設立された。1999年には、英国に英国国立医療技術評価機構(NICE)が設立された。
医学教育の分野では、カナダ、米国、英国、オーストラリアなどの医学部が、EBMを教えるプログラムを提供している。2009年に行われた英国のプログラムに関する調査では、英国の医学部の半数以上がエビデンスに基づく医療に関する何らかのトレーニングを提供していることが明らかになったが、その方法や内容はかなり異なっており、カリキュラムの時間や訓練を受けたチューター、教材の不足によってEBM教育が制限されていた。しかし、個々の医師がエビデンスにアクセスしやすくなるよう、多くのプログラムが開発されてきている。例えば、臨床診療のデータベース、UpToDateは1990年代初頭に立ち上げられ 、コクラン共同計画は1993年にエビデンスレビューの出版を開始した。1995年には、BMJ出版グループは、医療従事者向けに重要な臨床上の疑問点に関するエビデンスの現状を簡潔にまとめた6ヵ月ごとの定期刊行物であるClinical Evidenceを創刊した。日本においては、日本医療機能評価機構が診療ガイドラインの作成マニュアルを無料公開している。
医療サービス・ガバナンス
2000年までに、エビデンスに基づくという用語の使用は、医療システム内の他のレベルにも広がった。その例として、エビデンスに基づく医療サービスがあり、これは医療サービスの意思決定者の能力を高め、組織や機関レベルでのエビデンスに基づく医療の実践を目指すものである。
エビデンスに基づくガイドラインや方針は、倫理的な臨床判断を志向する、経験に基づく実践と容易に「ハイブリッド化」できない可能性があり、矛盾、争い、意図しない危機を招く可能性がある。最も効果的な「知識リーダー」(管理者や医療従事者のリーダー)は、意思決定において、形式的なエビデンスだけでなく、幅広いマネジメントの知識を用いている。エビデンスに基づくガイドラインは、医療における統治性(governmentality)の基礎を提供する可能性があり、その結果、現代の医療制度のガバナンスにおいて中心的な役割を果たしている。
EBMの方法論
エビデンスに基づくガイドライン作成のステップ
明確なエビデンスに基づくガイドラインをデザインするための手順は、1980年代後半に以下のように記述されている。
- 問題(クエスチョン)を明確にする(集団、介入、比較介入、アウトカム、時間軸、設定)。
- 文献を検索し、問題を示唆する研究を特定する。
- 各研究を解釈し、問題に関して何が述べられているかを正確に判断する。
- 複数の研究が問題を扱っている場合は、それらの結果を統合する(メタアナリシス)
- エビデンスを表にまとめる。
- ベネフィット、危害、コストをバランスシートで比較する。
- 望ましい実践について結論を出す。
- ガイドラインを書く。
- ガイドラインの根拠を書く。
- 他の人にそれまでの各ステップをレビューしてもらう。
- ガイドラインを実践する。
個人レベルのEBM実践のステップ
医学教育や個人レベルの意思決定の目的で、実践におけるEBMの5つのステップが1992年に説明され、2003年のEvidence-Based Health Care Teachers and Developers Conferenceに出席した代表者の経験が5つのステップにまとめられ、2005年に発表された。この5つのステップのプロセスは、大まかに以下のように分類できる。
- 不確実性部分を回答可能なクエスチョンに変換する。それらには批判的クエスチョン、研究デザイン、エビデンスレベルが含まれる。現在対処しなければいけない課題の中から、どのような情報が必要か、問題点を抽出する。問題(臨床疑問 (Clinical Question:CQ))の定式化の基本形は、
- Patient:どんな患者が
- Intervention (Exposure):どんな介入を行われる・暴露を受けるのは
- Comparison:どんなものと比較して
- Outcome:どうなるか、のように、4つのパーツで構成される。そのため、"four parts question" と呼ばれることもある。また、それぞれのパーツの頭文字を取ってPI(E)COと呼ばれる。なお、以下のように定式化されることもある。
- P:Patients(患者)、Problem(問題)、Population(対象者)
- I:Interventions(介入)
- C:Comparisons(比較対照)、ControlsまたはComparators(対照)
- O:Outcome(アウトカム)。以上にTimingとSettingを加えることもある。
- 入手可能な最善のエビデンスの体系的検索
- 内的妥当性に関するエビデンスの批判的評価:以下の側面に分けられる。
- 選択バイアス、情報バイアス、交絡の結果としての系統誤差
- 診断と治療の定量的側面
- 効果量とその精度に関する側面
- 結果の臨床的重要性
- 外的妥当性または一般化可能性(generalizability)
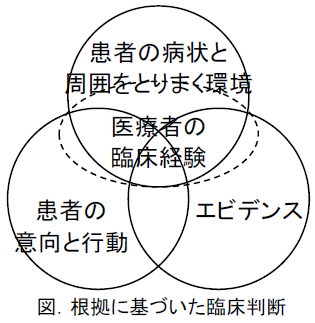
- 実践における結果の適用。Step 4で考慮すべきことは、以下の4種が挙げられている。このいずれかが欠けても問題が発生する。
- リサーチエビデンス
- 臨床状況と環境
- 患者の嗜好と行動
- 臨床経験
- 実績の評価。上記の判断が正しかったかどうかを事後評価し、今後のプロセス改善につとめる。
過去のEBM教育ではこのStep 1〜3の方法論を研ぎ澄ませることに重きを置き、またStep 4については必ずしも言葉で説明を尽くされて来なかったことから、医療者の中には「良い臨床研究を見つけて医療をマニュアル化することがEBMである」との誤解が広まった時期がある。
エビデンスのレビュー
発表された研究を元にしたシステマティックレビューは、特定の治療法の評価の主要な部分である。コクラン共同計画は、システマティックレビューを行う最も有名な組織の一つである。他のシステマティックレビューの作成者と同様に、著者は文献検索とエビデンスの評価に関する再現可能な計画だけでなく、詳細な研究プロトコールを提供する必要がある。最良のエビデンスが評価された後、治療は以下の3つに分類される。
- 有益である可能性が高い。
- 有害である可能性が高い。
- 有益または有害のいずれをも支持するエビデンスがない。
コクラン共同研究レビューグループ全50の1,016件のシステマティックレビューを2007年に分析したところ、レビューの44%が介入は有益である可能性が高く、7%が介入は有害である可能性が高く、49%が有益性も有害性も支持するエビデンスはないと結論づけられた。96%でさらなる研究が推奨されていた。2017年には、米国の民間医療保険支払者の方針決定に情報を提供するためにコクラン共同計画が作成したシステマティックレビューの役割を評価する研究が行われ、米国の主要な民間医療保険支払者の方針文書がコクランのシステマティックレビューから情報を得ているものの、さらなる利用を奨励する余地が残っていることが示された。
エビデンスの質の評価
EBMでは、さまざまなタイプの臨床エビデンスを分類し、医学研究につきまとうさまざまなバイアスからの自由度の強さに従って、それらを格付けまたは等級付けしている。例えば、治療的介入に関する最も強力なエビデンスは、均質な患者集団と病状を対象とし、完全な追跡を伴い、無作為化され、十分に盲検化されたプラセボ対照試験のシステマティック・レビューによって提供される。対照的に、患者の証言、症例報告、専門家の意見でさえも、プラセボ効果、症例の観察と報告に固有の偏り、誰が専門家であるかを確認することが困難であるため、エビデンスとしての価値はほとんどない。ただし、専門家の意見は「経験的証拠(empirical evidence)の形式を表していないため、経験的証拠の質のランキングには属さない」という批判もあり、「専門家の意見は、経験的証拠のみに限定された階層には当てはまらない、別個の複雑なタイプの知識であると思われる」と続けられている。
いくつかの組織が、エビデンスの質を評価するための格付けシステムを開発している。例えば、1989年に米国予防医療専門委員会(USPSTF)は以下のシステムを発表した。
- レベルI:少なくとも1件の適切にデザインされたランダム化比較試験から得られたエビデンス。
- レベルII-1:ランダム化が行われていないが、十分にデザインされた対照試験から得られたエビデンス。
- レベルII-2:適切にデザインされたコホート研究または症例対照研究、できれば複数の施設または研究グループから得られたエビデンス。
- レベルII-3:介入の有無を問わず、複数の時系列デザインの研究から得られたエビデンス。非対照試験における劇的な結果もこのタイプのエビデンスとみなされる可能性がある。
- レベルIII:臨床経験、記述的研究、または専門家委員会の報告に基づく、信頼できる権威者の意見。
もう一つの例は、オックスフォード大学EBMセンター(Centre for Evidence-Based Medicine: CEBM)が発表したオックスフォードCEBMエビデンスレベルである。2000年9月に初めて発表されたこのエビデンスレベルは、予後、診断、治療の効果、治療の有害性、スクリーニングに関する主張のエビデンスをランク付けする方法を提供するもので、当時ほとんどの評定方式では対応していないものであった。当初のCEBMレベルは、エビデンスを見つけるプロセスを実行可能にし、その結果を明示するために、Evidence-Based On Callとされた。2011年、国際的なチームがオックスフォードCEBMレベルを再設計し、より理解しやすくし、最近のエビデンスランキングスキームの進展を考慮した。オックスフォードCEBMエビデンスレベルは、乾癬における光線療法と外用療法の最適な使用に関する推奨や、カナダにおける肝細胞がんの診断とモニタリングのためのBCLC病期分類システムの使用に関するガイドラインなど、臨床ガイドラインを作成するために、患者や臨床家だけでなく専門家も使用している。
2000年には、GRADE(Grading of Recommendations Assessment, Development and Evaluation)ワーキンググループによるシステムが開発された。GRADEシステムは、医学研究の質だけでなく、より多くの側面を考慮に入れている。GRADEシステムは、通常システマティックレビューの一環として、エビデンスの質の評価を実施する利用者に、結果の信頼性に対するさまざまな要因の影響を考慮するよう求めている。GRADE表の作成者は、観察された効果(数値)が真の効果に近いという確度の度合い(信頼値)に基づいて、エビデンスの質を評価するために4段階のうち1つを割り当てる。信頼値は、構造化された方法で5つの異なる領域に割り当てられた判断に基づいている。GRADE作業部会は、質に基づく「エビデンスの質」と「推奨の強さ」を、互いによく混同される2つの異なる概念として定義している。
システマティックレビューには、バイアスのリスクが低いランダム化比較試験や、バイアスのリスクが高い観察研究が含まれることがある。ランダム化比較試験の場合、エビデンスの質は高いが、以下の5つの異なる観点で格下げされる可能性はある。
- バイアスのリスク: 組み入れられた研究におけるバイアスが効果の推定値に影響を及ぼしている可能性に基づいて行われる判断。
- 不正確さ: 観察された効果の推定値が完全に変化する可能性に基づいて行われる判断。
- 間接性: 研究の実施方法と結果が実際にどのように適用されるかという特性の違いに基づいて行われる判断。
- 不一致: 含まれる研究間の結果のばらつきに基づいて行われる判断。
- 出版バイアス: すべての研究によるエビデンスが考慮されているかという疑問に基づいて行われる判断。
GRADEに基づく観察研究の場合、エビデンスの質は低いところから始まり、ダウングレードの対象となるほか、以下の3つの領域でアップグレードされる可能性がある。
- 効果が大きい: 方法論的に強力な研究では、観察された効果が十分に大きく、完全に変化する可能性は低い。
- 妥当な交絡により効果が変化する: 観察された効果を減少させると予想される交絡因子が存在するにもかかわらず、効果推定値は依然として有意な効果を示している。
- 用量反応勾配: 行われた介入は、用量が増加するほど効果が高くなる。これは、さらに投与量を増やせば、より高い効果が得られる可能性が高いことを示唆している。
GRADEによるエビデンスの質のレベルの意味は以下の通りである。
- 質の高いエビデンス: 著者は、提示された推定値が真の値に非常に近いと確信している。言い換えれば、さらなる研究が提示された結論を完全に変更する可能性は非常に低い。
- 中程度の質のエビデンス: 著者らは提示された推定値が真の値に近いと確信しているが、大幅に異なる可能性もある。言い換えれば、さらなる研究が結論を完全に変える可能性がある。
- 質の低いエビデンス: 著者は効果推定値に自信がなく、真の値は大幅に異なる可能性がある。言い換えれば、さらなる研究によって提示された結論が完全に変更される可能性が高い。
- 非常に質の低いエビデンス: 著者は推定値に確信を持っておらず、真の値は推定値と大幅に異なる可能性がある。言い換えれば、新たな研究によって提示された結論が完全に変わる可能性が高い。
推奨のカテゴリー
ガイドラインやその他の出版物では、臨床サービスに対する推奨は、リスクとベネフィットのバランスと、その情報の根拠となるエビデンスのレベルによって分類される。米国予防医学専門委員会 (USPSTF)は、以下のシステムを使用している 。
- レベルA:十分な科学的根拠により、臨床サービスの有益性が潜在的リスクを実質的に上回ることが示唆されている。医療従事者は対象となる患者とそのサービスについて話し合うべきである。
- レベルB:少なくとも妥当な科学的証拠により、臨床サービスの有益性が潜在的リスクを上回ることが示唆される。医療従事者は対象となる患者とこのサービスについて話し合うべきである。
- レベルC:少なくとも妥当な科学的根拠から、その臨床サービスが有益であることが示唆されるが、一般的な推奨には有益性とリスクのバランスが近すぎる。医療従事者は、個別に考慮する必要がない限り、このサービスを提供する必要はない。
- レベルD: 少なくとも妥当な科学的根拠は、臨床サービスのリスクが潜在的利益を上回ることを示唆している。医療従事者は、無症状の患者に日常的にこのサービスを提供すべきではない。
- レベルI:科学的根拠が乏しい、質が低い、または矛盾しており、リスクと有益性のバランスが評価できない。医療従事者は、臨床サービスを取り巻く不確実性を患者に理解させるべきである。
GRADEガイドラインのパネリストは、さらなる基準に基づいて強い推奨や弱い推奨を行うことができる。重要な基準には、望ましい効果と望ましくない効果のバランス(コストは考慮しない)、エビデンスの質、価値観と嗜好、コスト(資源利用)などがある。
統計的尺度
EBMは、検査や治療の臨床的有益性を数学的手法で表現しようとするものである。EBMの実践で用いられるツールには、以下のものがある。
- 尤度比 特定の診断の検査前オッズに尤度比を掛け合わせることで、検査後オッズが決定される。(オッズは[より馴染みのある]確率から計算することができ、また確率に変換することもできる)。これはベイズの定理を反映している。臨床検査間の尤度比の差は、与えられた臨床状況における有用性に従って、臨床検査の優先順位付けに使用できる。
- AUC-ROC 受信者操作特性曲線下面積(AUC-ROC)は、行われた検査の感度と特異度の関係を反映する。質の高い検査はAUC-ROCが1に近づき、臨床検査に関する質の高い出版物はAUC-ROCに関する情報を提供する。陽性と陰性のカットオフ値は特異度と感度に影響するが、AUC-ROCには影響しない。
- 治療必要数(Number needed to treat: NNT)/有害必要数(Number needed to harm: NNH)NNTとNNHはそれぞれ介入の有効性と安全性を臨床的に意味のある方法で表現する方法である。NNTは、1人の患者で望ましい結果(例えばがんからの生存)を達成するために治療が必要な人の数である。例えば、ある治療により生存の可能性が5%増加する場合、その治療によりさらに1人の患者が生存するためには、20人が治療される必要がある。この概念は診断検査にも適用できる。例えば、1人の女性が乳がんで死亡するのを防ぐために、10年間で1,339人の50~59歳の女性が乳がん検診を受ける必要がある場合、乳がん検診を受けるためのNNTは1339である。
臨床試験の質
EBMは、研究者が論文で報告した技術を批判的に評価することにより、臨床研究の質を客観的に評価しようとするものである。
- 試験デザインに関する考察:質の高い研究では、適格基準が明確に定義されており、データの欠落が最小限に抑えられている。
- 一般化可能性の検討:研究は狭く定義された患者集団にしか適用できず、他の臨床的状況に一般化できない可能性がある。
- 追跡調査(フォローアップ):定義されたアウトカムが発生するのに十分な時間があれば、前向き研究のアウトカムや、治療群と対照群の差を検出する研究の統計的検出力に影響が及ぶ可能性がある
- 統計的検出力:数学的計算により、患者数が治療群間の差を検出するのに十分かどうかを判断できる。否定的な研究結果は、有益性が無かった、または単に差を検出するのに十分な患者数が不足していることを反映している可能性がある。
EBMの限界および批判
EBMには多くの限界と批判がある。 EBMに対する様々な批判が発表されているが、広く引用されている分類法は2つあり、StrausとMcAlisterの3分類(医学の実践に普遍的な限界、EBMに特有の限界、EBMに対する誤解)とCohen・Stavri・Hersh の5分類(EBMは医学の哲学的基礎に乏しい、エビデンスの定義が狭すぎる、エビデンスに基づいていない、個々の患者に適用した場合の有用性に限界がある、医師と患者の関係の自律性を低下させる)がある。
発表されている反論には以下のようなものがある。
- ランダム化比較試験(RCT)など、EBMによって生み出された研究は、すべての治療状況に関連するとは限らない。研究は特定の集団に焦点を当てがちだが、個々のヒトは集団の標準から大きく異なることがある。人種、性別、年齢、併存疾患などの理由から特定の集団層は歴史的に十分に研究されてこなかったため、RCTから得られたエビデンスはそれらの集団に一般化できない可能性がある。従って、EBMは集団に適用されるが、このことは医療従事者が各患者の治療方法を決定する際に個人的な経験を用いることを妨げるものではない。ある著者は、「臨床研究から得られた知識は、目の前の患者にとって何が最善かという第一の臨床的疑問に直接答えるものではない」とし、EBMが臨床経験の価値を割り引くべきではないと提言している。また別の著者は、「EBMの実践とは、個人の臨床的専門知識と系統的研究から得られる最良の外部からの臨床エビデンスを統合することである」と述べている。
- EBMの理論的理想(何十万も存在しうるあらゆる狭い臨床的疑問は、複数のRCTのメタアナリシスとシステマティックレビューによって回答されるだろう)は、研究(特にRCT自体)が高価であるという限界に直面している。したがって、現実には、当面、EBMに対する需要は常に供給よりもはるかに高く、人類にできる最善のことは、乏しいリソースをトリアージして適用することである。
- 研究は、出版バイアスや学術出版における利益相反の影響を受ける可能性がある。例えば、産業界からの資金提供による利益相反がある研究は、その製品を支持する可能性が高い。EBMは、企業利益、規制の失敗、学問の商業化によって腐敗しているため、現代のEBMは幻想であると主張されている。
- システマティックレビューの方法論は、成文化された手順や基準が守られている場合でも、(i)組み入れ基準の選択(ii)結果尺度の選択、比較、分析(iii)、リスクとバイアスの評価において避けられない主観性に関して、バイアスや誤用の可能性がある。これらすべての問題の例は、Edmund J. Fordhamらが関連するレビューで分析したコクラン・レビューに見ることができる。
- RCTの実施時期とその結果が公表される時期との間にタイムラグが存在する。
- 結果が公表される時期とそれが適切に適用される時期との間にタイムラグが存在する。
- Hypocognition(新しい情報を入れることができる単純で統合された精神的枠組みの欠如)により、EBMの適用が妨げられる可能性がある。
- 価値観:患者の価値観はEBMの本来の定義で考慮されているが、価値観の重要性はEBMのトレーニングでは一般的に強調されておらず、現在研究中の潜在的な問題である。
2007年の研究では、100件のエビデンスのうち23件が2年以内に覆され、そのうち7件は出版された時点ですでに覆されていた。2018年の研究「なぜすべての無作為化比較試験は偏った結果をもたらすのか」は、最も引用された10件のRCTを評価し、試験は、無作為化が可能な少数の質問セットしか研究できず、一般的にサンプルの平均的な治療効果しか評価できないことから、結果を別の状況に外挿する際の限界まで、研究に概説された他の多くのものの中でも、幅広いバイアスや制約に直面していると主張した。
臨床現場におけるエビデンスの適用
EBMは強調されているにもかかわらず、検査や治療に対する患者の要求、エビデンスに関する情報へのアクセス失敗、科学的エビデンスの急速な変化のため、安全でない、または効果のない医療行為が行われ続けている。例えば、2003年から2017年の間に、ホルモン補充療法が安全かどうか、赤ちゃんに特定のビタミンを与えるべきかどうか、アルツハイマー病患者に抗うつ薬が有効かどうかなど、何百もの医療行為についてエビデンスが変化した。ある治療法が安全でないか有効でないことがエビデンスによって明確に示された場合でも、他の治療法が採用されるまでに何年もかかることがある。
エビデンスに基づく推奨が取り入れられなかったり、実施されなかったりする要因には様々なものがある。これには個々の医療従事者や患者(微視的)レベルでの認識不足、組織レベル(中間)レベルでの制度的支援不足、あるいは政策(巨視的)レベル以上での支援不足などが含まれる。また、大きな変化には、ある世代の医師が引退または死亡し、より新しいエビデンスで訓練された医師と交代する必要がある場合もある。
医師はまた、自分の逸話的経験と矛盾するエビデンスを拒絶したり、認知バイアス-例えば、治療拒否後に患者が死亡したような、稀ではあるが衝撃的な結果(利用可能性ヒューリスティック)の鮮明な記憶など-のために、エビデンスを拒絶したりすることがある。「何かをするため」、あるいは患者の感情的なニーズに応えるために過剰な治療をすることがある。患者が期待する治療とエビデンスが推奨する治療との間の不一致に基づいて、医療過誤の告発を心配することもある。また、その治療が生物学的にもっともらしく感じられるため、過剰な治療を行ったり、効果のない治療を行ったりすることもある。
臨床ガイドラインを作成する者の責任として、ガイドラインの普及を促進するための実施計画を盛り込む必要がある。実施プロセスには、実施計画、状況の分析、障壁と促進因子の特定、およびそれらに対処するための戦略の設計が含まれる。
医学教育
EBMに関するトレーニングは、医学教育の一連の流れの中で提供されている。医療従事者の教育のために、教育コンピテンシーが作成されている。
ベルリン質問票とフレズノテストは、EBMにおける教育の有効性を評価するための有効な手段である。これらの質問票は様々な場面で使用されている。
24の臨床試験を含むキャンベル・コラボレーションのシステマティックレビューでは、エビデンスに基づく医療知識と実践をeラーニングが有効に改善するかどうかが検討された。その結果、eラーニングは、学習しない場合と比較して、エビデンスに基づくヘルスケアの知識と技能を改善するが、態度や行動は改善しないことが明らかになった。eラーニングと対面式学習を比較しても、アウトカムに差はない。e-ラーニングと対面学習を組み合わせること(ブレンデッドラーニング)は、エビデンスに基づく知識、技能、態度、行動にプラスの影響を与える。e-ラーニングの一形態として、EBMスキルを高めるためにウィキペディアの編集に取り組む医学部の学生もおり、医学知識を伝えるスキルを高めるためにEBM教材を作成する学生もいる。
出典
参考文献
- Minds診療ガイドライン選定部会『Minds 診療ガイドライン作成の手引き 2007』医学書院、2007年。ISBN 978-4-260-00480-0。オリジナルの2012年5月29日時点におけるアーカイブ。https://web.archive.org/web/20120529210531/http://minds4.jcqhc.or.jp/minds/glgl/glgl.pdf。 (Minds医療情報サービス)
関連文献
- Understanding evidence in health care: Using clinical epidemiology. South Yarra, VIC, Australia: Palgrave Macmillan. (2012). ISBN 978-1-4202-5669-7
- Clinical Epidemiology: Principles, Methods, and Applications for Clinical Research. Jones & Bartlett Learning. (2009). ISBN 978-0-7637-5315-3
- The Philosophy of Evidence-based Medicine. Wiley. (2011). ISBN 978-1-4051-9667-3. https://books.google.com/books?id=O8djbHBva5IC
- Clinical Epidemiology & Evidence-Based Medicine: Fundamental Principles of Clinical Reasoning & Research. Sage. (2001). ISBN 978-0-7619-1939-1. https://archive.org/details/clinicalepidemio0000katz
- Care and Cure: An Introduction To Philosophy of Medicine. University of Chicago Press. (2018). ISBN 978-0-226-59517-7. https://www.press.uchicago.edu/ucp/books/book/chicago/C/bo29193227.html
- Minds診療ガイドライン作成マニュアル編集委員会『MINDs診療ガイドライン作成マニュアル』(3.0版)公益財団法人日本医療機能評価機構、2021年3月22日。https://minds.jcqhc.or.jp/docs/methods/cpg-development/minds-manual/pdf/all_manual_.pdf。
関連項目
- 事例証拠
- 臨床意思決定支援システム(Clinical decision support system: CDSS)
- 医学的コンセンサス
- オーダメイド医療
- 政策に基づく証拠作成(Policy-based evidence making: PBEM)
- 統計学
- プラグマティズム
- 健康情報学 - 臨床情報学
- 権威に訴える論証
- ジョアンナブリッグス研究所
- 防衛医療
外部リンク
- EBMの歴史(動画、英語), JAMA and the BMJ, 2014.
- オックスフォードEBMセンター (英語).
- The SPELL:EBMと生涯学習の広場
- Guidelines and Measures | Agency for Healthcare Research and Quality(英語)- EBM診療ガイドラインを公開(アメリカの国家事業)
- Mindsガイドラインライブラリ - EBM診療ガイドラインの公開(日本医療機能評価機構、厚生労働科学研究費補助金)
- NICE | The National Institute for Health and Care Excellence(英語)


![科学的根拠に基づく予防医療[ヘルスメインテナンス] 2022 (成人向け) YouTube](https://i.ytimg.com/vi/q_4zSvzQIv8/hqdefault.jpg?sqp=-oaymwEmCOADEOgC8quKqQMa8AEB-AHUBoAC4AOKAgwIABABGGUgZShlMA8=&rs=AOn4CLBdo7R6H48XOKHlYHh6HjkAfxGgRQ)
